Le strategie terapeutiche nel trattamento dello scompenso cardiaco avanzato: una review delle recenti linee guida
Lo scompenso cardiaco avanzato è caratterizzato dalla persistenza di sintomi e segni severi di insufficienza cardiaca, malgrado una terapia medica ottimale. La prevalenza di questa condizione sta aumentando, in parte per l’aumento dell’età media della popolazione, in parte per il miglioramento dell’assistenza medica a questi pazienti e, dunque, un aumento della loro aspettativa di vita e prevalenza.
Una nuova definizione dello scompenso cardiaco avanzato
Nel 2018 sono state aggiornati i criteri per la definizione dello scompenso cardiaco avanzato nell’update HFA-ESC 2018; tra questi criteri ricordiamo:
- La severità e la persistenza di sintomi di scompenso cardiaco malgrado la terapia medica ottimale;
- La disfunzione sistolica, con una LVEF <30%; vizi valvolari non operabili, malformazioni congenite non operabili, e livelli persistentemente elevati di BNP e NT-proBNP;
- Episodi di congestione polmonare e sistemici che necessitino di terapia diuretica ad alte dosi endovena, o una combinazione di essi, oppure una bassa gittata che richieda una terapia con inotropi e/o vasomotori oppure aritmie maligne che abbiano richiesto una ospedalizzazione non programmata nei 12 mesi precedenti;
- Severo deterioramento della tollerabilità all’esercizio.
Le strategie terapeutiche
Le strategie terapeutiche per la gestione di questi pazienti possono essere sia mediche che operative – ricorrendo all’ausilio di dispositivi meccanici di supporto al circolo. Questi devices vengono classificati in dispositivi a lungo e a breve termine e vengono utilizzati in diversi modi:
- Bridge to decision (BTD)/ Bridge to bridge (BTB): l’uso di ECMO e Impella nei pazienti con shock cardiogeno fino a che si stabilizzi l’emodinamica e la perfusione d’organo; essi permettono di prendere tempo in attesa di decidere quale strategia terapeutica sia più adeguata al paziente;
- Bridge to candidacy (BTC): l’uso di LVAD (left ventricular assisted device) per migliorare la perfusione d’organo per rendere un paziente elegibile per un trapianto di cuore;
- Bridge to transplantation (BTT): L’utilizzo di LVAD, BiVAD (biventricular assisted device) o TAH (total artificial heart) per mantenere il paziente in vita, che altrimenti sarebbe ad alto rischio di morte cardiaca improvvisa prima dell’arrivo del trapianto;
- Bridge to recovery (BTR): l’uso dell’MCS (mechanical circulatory support) per mantenere in vita il paziente fino a che il suo cuore recuperi;
- Destination therapy (DT): LVAD a lungo termine è una strategia terapeutica alternativa per chi non è elegibile al trapianto cardiaco.
I profili dei pazienti con scompenso cardiaco avanzato
Secondo la Interagency registry for mechanically assisted circulatory support profile descriptions of patients with advances heart failure esistono sette profili di pazienti con insufficienza cardiaca avanzata, ciascuno dei quali necessita di una gestione terapeutica diversa, a seconda della gravità del quadro clinico.
La flowchart al lato, tratta dalle Linee Guida ESC 2021, riassume una possibile algoritmo terapeutico per i pazienti affetti da insufficienza cardiaca avanzata, basandosi sulla stratificazione del rischio descritto dai profili INTERMACS e ricorrendo ai MCS precedentemente elencati o il trapianto cardiaco.
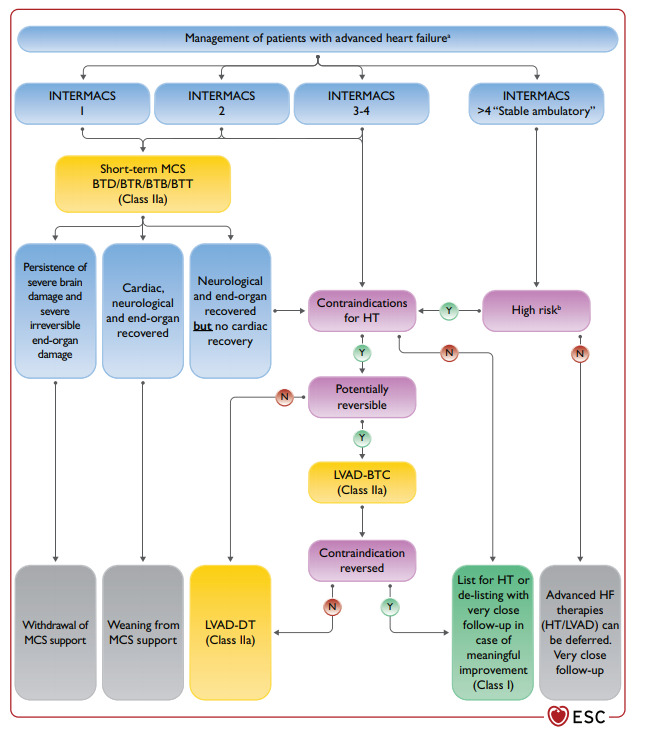
Come si evince dalla flowchart fino al profilo 4 si può ricorrere a un MCS a breve termine, che verrà discontinuato sia nel caso in cui ci sia un miglioramento della funzione cardiaca, neurologica e della perfusione degli altri organi vitali, sia laddove il danno neurologico severo persista e diventi irreversibile.
Nei pazienti con un profilo INTERMACS ad alto rischio, d’altra parte, si valuta subito l’eleggibilità del paziente a un trapianto cardiaco ed eventualmente si mette in lista; in caso ciò non fosse possibile si ricorre a un dispositivo di assistenza ventricolare a lungo termine o, in alternativa, alle cure palliative.
La terapia farmacologica in questi pazienti è un’alternativa che deve sempre essere percorsa e consiste nell’utilizzo di diuretici endovena ad alte dosi, eventualmente in combinazione nei casi di resistenza, per trattare i sintomi di congestione polmonare e periferica. La funzione renale, invece, spesso severamente compromessa come conseguenza dell’ipoperfusione, viene in parte ripristinata con la dialisi.
Il trapianto cardiaco: il gold standard per la terapia dello scompenso cardiaco avanzato
Il trapianto di cuore, infine, rappresenta il gold standard per il trattamento dei pazienti con insufficienza cardiaca avanzata. La sopravvivenza a un anno è circa del 90% e la sopravvivenza globale mediana è di circa 12.5 anni. Le principali sfide del trapianto sono rappresentate dalla disfunzione primaria dell’organo trapiantato, gli eventi correlati all’immunosoppressione – come le infezioni, le neoplasie – o al rigetto d’organo – come la vasculopatia dell’allograft cardiaco – o a complicanze cardiovascolari – quali diabete e ipertensione – e non cardiovascolari – quale l’insufficienza renale.
Le principali controindicazioni al trapianto, che vengono citate anche nella flowchart precedente, sono rappresentate da:
- Infezione attiva;
- Severa arteriopatia periferica e/o cerebrale;
- Ipertensione polmonare irreversibile farmacologicamente;
- Neoplasia con prognosi infausta;
- Insufficienza epatica irreversibile (cirrosi) o malattia renale terminale, in questi casi a dire il vero si può considerare un doppio trapianto: cuore-rene o cuore-fegato.
- Malattia sistemica con coinvolgimento multiorgano;
- BMI pre-trapianto >35kg/m2 ;
- Dipendenza attuale da alcol o droghe;
- Instabilità psicologica che metterebbe a rischio un adeguato follow up;
Lo scompenso cardiaco acuto
Lo scompenso cardiaco acuto si definisce come l’improvvisa comparsa di segni e sintomi di una severa insufficienza cardiaca che necessita di un ricovero non programmato e immediate cure mediche adeguate. Può essere la conseguenza di una riacutizzazione di una insufficienza cardiaca cronica, o un esordio de novo; in quest’ultima circostanza la mortalità intraospedaliera è maggiore ma quella post-dimissione e il tasso di recidive a lungo termine è inferiore rispetto alle esacerbazioni.
La gestione di un paziente con insufficienza cardiaca acuta segue una serie di indicazioni standardizzate. È fondamentale e raccomandato eseguire:
- Un ECG: al momento dell’ammissione, del ricovero e prima della dimissione per rilevare la presenza di aritmie ventricolari o segni di ischemia, di ipertrofia ventricolare;
- Un ecocardiogramma transtoracico per studiare il cuore sia da un punto di vista morfologico che funzionale, determinando la FE %;
- RX del torace che, insieme a un’ecografia polmonare, rileva i segni di congestione polmonare, ed eventuali focolai infettivi;
- Il dosaggio di BNP e NT-pro BNP;
- Il dosaggio delle troponine;
- Il dosaggio del TSH;
- La valutazione dell’equilibrio elettrolitico e della funzionalità renale;
- La valutazione dell’assetto marziale;
- Il dosaggio della procalcitonina per rilevare eventuali stati settici, come una polmonite;
- Il dosaggio del D-dimero per escludere la diagnosi di embolia polmonare, in caso di livelli normali;
- Il dosaggio dei lattati che è indice indiretto della perfusione;
- La misurazione della saturazione di ossigeno mediante la pulsissometria e l’esecuzione di un’emogasanalisi.
Possiamo distinguere quattro quadri clinici principali:
- L’insufficienza cardiaca cronica scompensata;
- L’edema polmonare;
- L’insufficienza ventricolare destra isolata;
- Lo shock cardiogeno;
Francesco Lodoli per Questione Civile
Bibliografia
- Theresa A McDonagh, Marco Metra, Marianna Adamo, Roy S Gardner, Andreas Baumbach, Michael Böhm, Haran Burri, Javed Butler, Jelena Čelutkienė, Ovidiu Chioncel, John G F Cleland, Andrew J S Coats, Maria G Crespo-Leiro, Dimitrios Farmakis, Martine Gilard, Stephane Heymans, Arno W Hoes, Tiny Jaarsma, Ewa A Jankowska, Mitja Lainscak, Carolyn S P Lam, Alexander R Lyon, John J V McMurray, Alexandre Mebazaa, Richard Mindham, Claudio Muneretto, Massimo Francesco Piepoli, Susanna Price, Giuseppe M C Rosano, Frank Ruschitzka, Anne Kathrine Skibelund, ESC Scientific Document Group , 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: Developed by the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) With the special contribution of the Heart Failure Association (HFA) of the ESC, European Heart Journal, Volume 42, Issue 36, 21 September 2021, Pages 3599–3726, https://doi.org/10.1093/eurheartj/ehab368.


