La scoperta dello scienziato Alexander Fleming: la penicillina
Una delle scoperte piu importanti della medicina, quella della penicillina, da parte dello scienziato Premio Nobel Alexander Fleming. In questo articolo in collaborazione tra l’Area di Scienze e quella di Storia Contemporanea, verranno illustrate le tappe che hanno portato alla sua scoperta.
Cenni biografici su Alexander Fleming
Alexander Fleming nasce il 6 agosto 1881 in Scozia. Verso l’etá di 13 anni si trasferisce a Londra, dove vive con uno dei fratelli, Thomas, che studia medicina nella capitale inglese. Studia in città e lavora per quattro anni per un’ azienda di spedizioni. A venti anni eredita una somma di denaro da un suo zio e si iscrive alla St. Mary’s Hospital Medical School, sempre a Londra.
Inizia a far parte del club dei fucilieri della scuola; il suo capitano gli consiglia di seguire la strada della batteriologia e di entrare a far parte del team di ricerca. Nel 1906 consegue la laurea e continuerá ad insegnare presso l’istituto fino allo scoppio del primo conflitto mondiale.
Fleming durante la guerra e la scoperta del lisozima
Nel 1915 convola a nozze con l’infermiera Sarah Marion McElroy. Durante la Grande Guerra, prestando servizio nell’esercito inglese, assiste i feriti. Dopo la fine del conflitto, torna alla sua professione di medico.
Nel 1922 avviene la prima grande scoperta ovvero quella del lisozima, un enzima che previene le infezioni. Fleming la realizza in modo abbastanza semplice: lascia per qualche settimana del muco nasale in un recipiente la e nota che, attorno ad esso, si sviluppano dei microbi.
La penicillina
Nel 1928 Fleming sta studiando un altro batterio, lo stafilococco. Dopo qualche tempo, nota che è stato contaminato da un fungo: i batteri a contatto con esso sono stati distrutti. Analizzando questa muffa, la identifica come appartenente al genere Penicillium. Il 7 marzo 1929 viene ufficialmente chiamata Penicillina.
Gli altri studi e il premio Nobel
Dopo qualche anno, Fleming scopre che anche altri due medici di Oxford, Howard Florey ed Ernst Boris Chain, riescono a dimostrare gli effetti della penicillina. Durante la Seconda guerra mondiale, gli studi vengono finanziati con ingenti somme di denaro da parte di Inghilterra e Stati Uniti. La scoperta della penicillina porta lui e i suoi colleghi a ricevere, nel 1945, il premio Nobel per la medicina.
Muore dieci anni dopo, a 74 anni, per un arresto cardiaco.
Cenni sulla struttura della parete batterica
La penicillina fa parte di quel gruppo di antibiotici che inibiscono la sintesi della parete batterica. Per capire come sia possibile, verrà descritta sommariamente la struttura di una cellula batterica.
La maggior parte dei batteri sono provvisti di una parete batterica sulla base della cui struttura si distinguono due categorie: batteri Gram + e Gram -. Le penicilline sono attive specialmente sui batteri gram+, perché interferiscono con le reazioni di transglicosilazione e traspeptidazione, indispensabili per la formazione dei peptidoglicani – componente imprescindibile di questi patogeni.
I batteri gram+ sono dotati una membrana plasmatica, uno spazio periplasmatico – esterno – e una parete formata da peptidoglicani. Questi altro non sono che delle catene polisaccaridiche (di zuccheri) formate dall’alternanza di due zuccheri semplici alternati: N-acetilglucosamina (NAG) acido N-acetil muramico (NAM). Legata a quest’ultimo c’è una catena di 5 amminoacidi che termina con due residui di D-Alanina.
Tra le catene amminoacidiche di catene polisaccaridiche diverse, poste l’una di fronte all’altra, si instaurano dei legami definiti crociati tra il terzo amminoacido (una lisina) di una e il quarto dell’altra (D-alanina). La reazione che permette la formazione di questi ponti si chiama transpeptidazione. Questa reazione è catalizzata da un enzima, nonché bersaglio delle penicilline, chiamato PBP2 (penicillin binding protein 2).
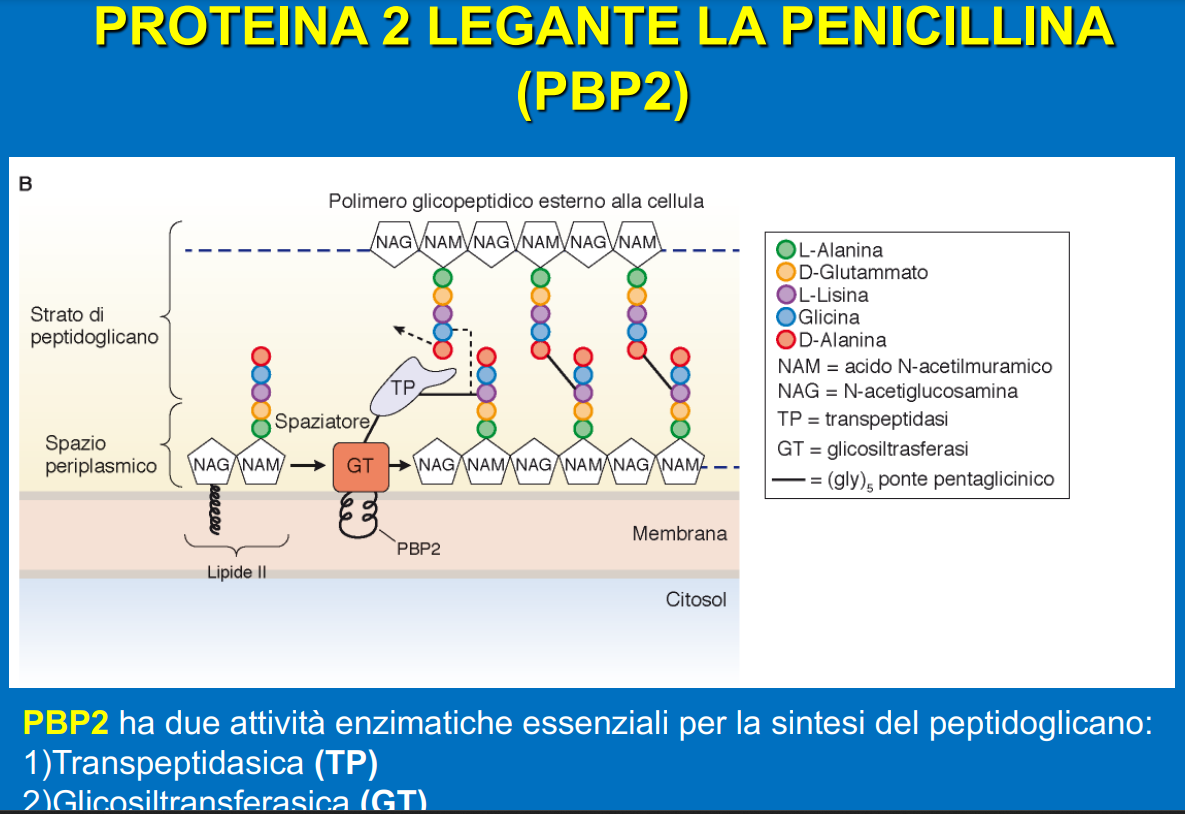
Impedendo la formazione dei legami crociati l’integrità della parete risulta gravemente compromessa e per questo la cellula potrebbe andare in lisi osmotica – il batterio esplode perché troppa acqua entra al suo interno.
La chimica della penicillina e l’antibiotico resistenza
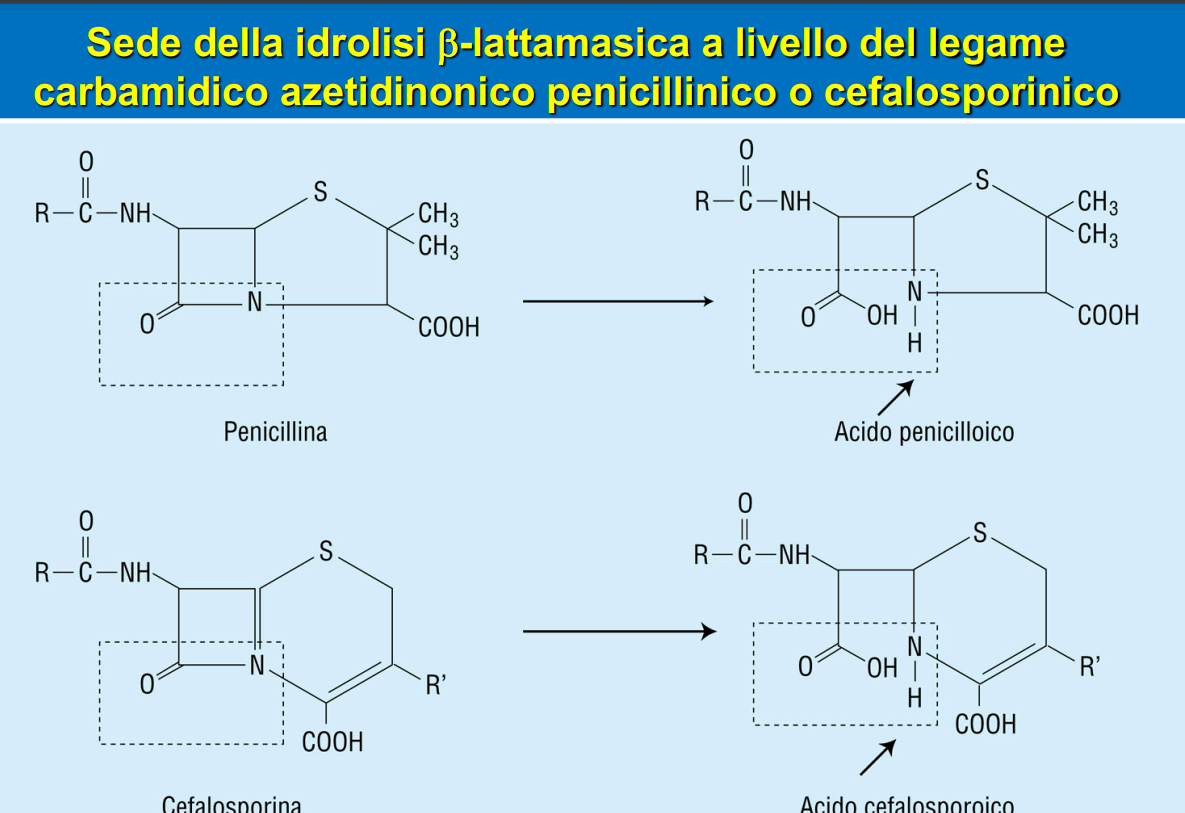
La penicillina è un antibiotico definito beta-lattamico, perché il sito attivo, che le consente di svolgere le sue funzioni è l’anello beta-lattamico, appunto. Questo ha delle caratteristiche chimiche che lo rendono molto simile al dipeptide D-Ala che rappresenta il substrato della PBP2.
Ci sono degli enzimi prodotti dai batteri chiamati beta-lattamasi che sono in grado di idrolizzare questo anello determinando dunque l’inattivazione dell’antibiotico. Queste proteine conferiscono al batterio resistenza a molti antibiotici beta-lattamici.
Per ovviare a questo inconveniente, si aggiungono agli antibiotici delle molecole che inibiscono l’attività delle beta-lattamasi batteriche, come l’acido-clavulanico o il tazobactam. Alcune penicilline, invece, sono intrinsecamente resistenti all’inattivazione degli enzimi batterici, come la meticillina.
Altri metodi attraverso cui il batterio riesce a sviluppare resistenza sono:
– Riduzione della penetrazione del farmaco nel patogeno: o limitando il numero di “porte di ingresso” (le porine) o aumentando le pompe di efflusso (glicoproteina P);
– Modificazione del bersaglio dell’antibiotico, in modo che quest’ultimo non possa più riconoscerlo;
Un problema sempre più diffuso, purtroppo, è proprio quello della resistenza batterica. L’uso incauto e non razionale degli antibiotici, la contaminazione alimentare con antibiotici ad ampio spettro, l’aumento dei pazienti immunodepressi – a causa di terapie antiblastiche o immunosoppressive o malattie del sistema immunitario – sono solo alcuni dei fattori che contribuiscono a selezionare ceppi batterici sempre più abili a eludere l’offensiva degli antimicrobici. Un esempio di questo fenomeno, che riguarda proprio la meticillina è lo staphylococcus Aureus meticillina-resistenza (MRSA), responsabile di molte infezioni nosocomiali difficilmente trattabili, ma recentemente riscontrabili anche nella popolazione generale.
Diversi tipi di penicillina
Esistono diversi tipi di penicillina ma in primo luogo possiamo distinguerle in penicilline naturali e sintetiche.
Le penicilline naturali sono:
– La penicillina G: una forma gastrolabile, cioè instabile all’acidità gastrica e per questo deve essere necessariamente somministrata per via endovenosa.
– La penicillina V: una forma gastroresistente che può essere somministrata anche per via orale.
Tra quelle sintetiche ricordiamo:
1) Penicilline a spettro esteso o aminopenicilline – AMPICILLINA (ampicillina/sulbactam, AMPLITAL ) – AMOXICILLINA (amoxicillina/acido clavulanico, ZIMOX)
2) Penicilline a spettro più esteso o Carbossipenicilline o antipseudomanas – CARBENILCILLINA, INDANILCILLINA, TICARCILLINA
3) Penicilline a spettro estesissimo o ureidopenicilline o antiklebsiella – PIPECARCILLINA, MEZLOCILLINA, AZLOCILLINA
4) Penicilline b-lattamasi resistenti – METICILLINA, NAFCILLINA, ISOXAZOLIL-PENICILLINE (OXACILLINA, CLOXACILLINA, DICLOXACILLINA, FLUCLOXACILLINA).
Spettro di azione
I principali bersagli delle penicilline sono come già detto i batteri gram +, ma non solo. Le infezioni per le quali si utilizza sono molte:
– Le faringotonsilliti da Staphylococchi o da streptococchi;
– Le polmoniti pnuemococciche;
– Meningiti batteriche, sia da pneumococchi che da meningococchi;
– Malattie a trasmissione sessuale (come la gonorrea o la sifilide);
– Difterite, antrace, clostridi etc…;
Normalmente la penicillina non penetra nelle meningi, ma in caso di infiammazione delle stesse la barriera ematoencefalica aumenta la propria permeabilità permettendo all’antibiotico di raggiungere anche il SNC.
L’escrezione è prevalentemente renale.
Effetti avversi
Pur essendo un antibiotico con un elevato indice terapeutico (cioè piuttosto sicuro), come tutti farmaci ha degli effetti avversi, tra i quali ricordiamo:
– Reazioni di ipersensibilità: cioè allergia. In alternativa si possono usare i macrolidi, ma non le cefalosporine a causa della sensibilità crociata;
– Nefrotossicità (specialmente la nafcillina);
– Neurotossicità: si può usare il probenecid (farmaco anti-gotta) per aumentare la velocità di escrezione dell’antibiotico dal SNC;
– Tossicità ematologica;
Francesco Lodoli e Margherita Rugieri per Questione Civile
Bibliografia
Farmacologia generale e clinica Copertina rigida – 26 febbraio 2021
di Bertram G. Katzung (Autore), Paolo Preziosi (a cura di)
Sitografia
www.storicang.it
www.geopop.it
www.microbiologiaitalia.it



